Атом Бора
Датский физик Нильс Бор применил новую квантовую концепцию к атому. Бор родился в Копенгагене, в богатой семье. В юности он был известным футболистом: вместе с братом играл в лучших национальных командах. Бор учился в Копенгагенском университете и защитил диссертацию в 1911 году. Поворотной точкой в его карьере стала работа в Англии после защиты диссертации. Вначале Бор поехал в Кембридж, но после знакомства с Резерфордом решил переехать в Манчестер. Это было как раз то время, когда Резерфорд подтвердил своими экспериментами с альфачастицами «модель солнечной системы» для атома.

Все атомы одного элемента одинаковы, однако простая модель Солнечной системы не указывает точно, где должны располагаться электроны в этих атомах. В самой Солнечной системе нет жестких физических ограничений того, на каких расстояниях от Солнца могут располагаться планеты. Скажем, орбита Земли могла бы быть немного больше или немного меньше, чем она есть. И еще одна проблема этой модели: обращающийся по орбите электрон похож на колеблющийся заряд в антенне и поэтому должен излучать энергию с частотой своего орбитального движения. Но, в отличие от антенны радиостанции, у электрона нет внешнего источника энергии. В конце концов потеря энергии должна привести к падению электрона на ядро атома.
Именно над этими проблемами Бор размышлял в Манчестере. Только через два года он смог найти решение. Один из друзей уговорил его посмотреть на формулу спектральных линий водорода, которые Бальмер открыл на несколько десятков лет ранее. «Когда я увидел формулу, то сразу же все понял», — сказал Бор год спустя. Он предположил, что в атоме водорода электрон находится на орбите вокруг протона и их связывает электрическое притяжение. По мнению Бора, в отличие от планет Солнечной системы, у всех атомов данного элемента Возможны только определенные радиусы орбит. Во всем остальном электрон может подчиняться законам механики.
Другим отклонением от стандартной физики было требование Бора, чтобы Электрон, двигаясь по разрешенной орбите, не излучал. Это противоречит теории электромагнитного излучения. Но Бор связал излучение с другим явлением — с изменением орбиты электрона. Каждая круговая орбита электрона обладает определенной энергией, которая тем больше, чем дальше от протона находится эта орбита. Электрон может перепрыгнуть с верхней (то есть более далекой) орбиты на нижнюю, излучив при этом фотон, энергия которого соответствует разности энергий этих двух орбит. И наоборот, электрон может захватить пролетающий мимо фотон с энергией, необходимой для его перехода на более высокую орбиту.

А поскольку разрешены орбиты только с определенной энергией, то между ними возможны только определенные разности энергий и соответствующие им фотоны. Вспомните ступеньки лестницы: вы не сможете стоять на или перепрыгнуть через половину ступени, вы можете шагать только через целое число ступеней. Так как величина энергии фотона связана с его длиной волны, то лишь определенные длины волн могут присутствовать в излучении атома водорода. Формула Бальмера связывает длины волн с целыми числами. Бор понял, что это номера орбит в порядке увеличения их расстояния от ядра. Например, серия бальмеровских линий излучается, когда электрон в атоме водорода прыгает на орбиту номер 2 с более высоких орбит.
Отклики на статью были самые разные, начиная с замечания лорда Рэлея: «Я не вижу в статье ничего полезного» до восторга, с каким принял статью Эйнштейн. Эйнштейн признался, что у него были такие же мысли, но не хватило смелости дать им ход.
В 1919 году Бор стал профессором теоретической физики в Копенгагене. Для продолжения его исследований был создан специальный институт, впоследствии один из ведущих центров по развитию Атомной физики, Место, где могли встречаться ученые из разных уголков мира, что было непросто после Первой мировой войны.
Модель Бора настолько хорошо описывает излучение атома, что постепенно ее стали считать реальной. Но потребовалось ее развитие. Арнольд Зоммерфельд (1868-1951) начал использовать модель атома с эллиптическими орбитами электронов. Он считал, что, наряду с круговой орбитой, электрон может иметь и эллиптическую орбиту того же диаметра. Позже от движения электронов по орбитам вообще отказались, и от первых моделей с орбитами осталась лишь идея об энергетических уровнях. Атом может перейти на уровень с большей энергией, то есть — Возбудиться. После того как пройдет возбуждение, атом испускает фотон.
 Единство волн и частиц
Единство волн и частиц Здравый смысл и реальность
Здравый смысл и реальность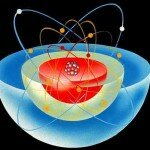 Структура атомов
Структура атомов Расплывчатые частицы: принцип неопределенности Гейзенберга
Расплывчатые частицы: принцип неопределенности Гейзенберга Механика атомов
Механика атомов