Сегрегация элементов
Сегрегация элементов: некоторые геохимические правила
Многие геологические процессы, такие, как выветривание, осадконакопление, метаморфизм и частичное плавление, непрерывно отделяют одни химические элементы от других в ходе циклического преобразования горных пород. Например, физические и химические процессы обусловливают раздельное отложение осадков песчаных пляжей (Si02), известняковых рифов (СаСОэ) и залежей угля (преимущественно углерод).

Поведение различных элементов как на поверхности, так и внутри планет определяется их электронной конфигурацией и сродством по различным типам кристаллических связей. В дифференцированных метеоритах, например, элементы собираются в ясные, хотя и перекрывающиеся, группы силикатов, сульфидов и металлов. Выделяют следующие группы элементов:
а)Литофильные (от греческого «литое»-камень) элементы, которые встречаются, как правило, в соединении с кислородом в окислах и силикатах: Rb, К, Ва, Na, Sr, Са, Mg и др.
б)Халькофильные (от греческого «халькос»- медь) элементы, встречающиеся в основном в сульфидах: Си, Zn, Pb, Sn, Ag и др.
в)Сидерофильные (от греческого «сидерос»- железо) элементы, встречающиеся обычно в металлическом виде: Fe, Ni, As, Pt, Ir, Au и др.
Те же правила применимы ко всем земным породам, и, очевидно, они связаны с фундаментальными свойствами элементов. По сути дела, способность элементов входить в те или иные соединения зависит от их положения в Периодической системе. Здесь мы упростим дело, используя только одно свойство каждого из элементов-его электроотрицательность Е, которую измеряют в безразмерных величинах от 0 до 4 по шкале, предложенной Полингом. Указанное свойство-это способность атома притягивать электроны и становиться вследствие этого отрицательно заряженным анионом.
Так, эта величина принимает наивысшее значение у галогенов (F», 4,0), она высока также у кислорода (О2 3,5), имеет среднее значение у серы (S21,5). Однако она низка у элементов со свойствами металлов: они теряют электроны и становятся положительно заряженными катионами (например, Mg2+, 1,2; Si4+ , 1,8; Fe2+, 1,8). Кроме кислорода, серы и нескольких сложных анионов (например, силикатов, фосфатов и т.д.), все остальные интересующие нас элементы образуют катионы..
Если два каких-либо элемента заметно различаются по значениям то образующаяся между ними связь будет, скорее всего, ионной, для которой характерно сильное электростатическое притяжение (например, NaCl). Все указанные элементы со значениями Е меньше 1,6 обладают сродством для образования ионной связи с кислородом и демонстрируют тем самым на планетах земной группы литофильное поведение.
За исключением элементов, также относящихся к литофильным из-за их большого заряда, способствующего образованию сложных анионов с кислородом, другие элементы со значениями Е между 1,6 и 2,0 относятся, как правило, к халькофильным. Это связано с тем, что они мало отличаются по электроотрицательности, скажем, от серы (Е = 2,5); в результате эти элементы как бы «делят» электроны между собой, образуя, следовательно, ковалентные связи. На деле существует целый ряд различных разновидностей связи от полностью ионной до полностью ковалентной, что зависит от электроотрицательности соединяющихся элементов.
Третий тип встречающейся в природе связи характерен для металлов
Третий тип встречающейся в природе связи характерен для металлов, которые имеют правильную структуру с плотной упаковкой и часто состоят из атомов только одного вида. Положительно заряженные металлические ионы окружены «газом», состоящим из подвижных электронов, что и обусловливает высокую тепло- и электропроводность металлов. К этой группе относятся элементы, имеющие электроотрицательность между 2,0 и 2,4; они называются сидерофильными, так как на Земле часто встречаются вместе с металлическим железом. Здесь заключен интересный парадокс, поскольку железо, дающее название этой группе, имеет значение электроотрицательности 1,8 и должно быть отнесено, по принятой здесь классификации, к халькофильным элементам.
Прежде чем объяснить этот парадокс, приведем зависимость между электроотрицательностью элементов и их геохимическим сродством:
- литофильные элементы: Е< 1,6, но, кроме того, элементы с более высокими значениями Е, образующие сложные анионы;
- халькофильные элементы: 1,6 < Е < 2,0, за исключением упомянутых выше элементов, образующих сложные анионы;
- сидерофильные элементы: 2,0 < Е < 2,4. (По классификации, принятой в Периодической системе, наиболее литофильные элементы-это катионы щелочной и щелочноземельной групп, тогда как халькофильные и сидерофильные относятся главным образом к переходным группам, причем для сидерофильных элементов характерна тенденция иметь высокие массовые числа.)
Что же можно сказать, исходя из этих геохимических правил
Что же можно сказать, исходя из этих геохимических правил, относительно распределения элементов в недрах планет земной группы? Это распределение зависит от относительного содержания главных присутствующих элементов; в планете, имеющей состав углистых хондритов, 92% массы приходится всего на пять элементов, а именно на железо, кислород, кремний, магний и серу. Если дать этим элементам возможность образовывать соединения, то появится литофильный слой, в котором будут преобладать магниевые силикаты (оливины и пироксены).
При взгляде на относительное распределение масс, может показаться, что кислорода недостаточно, чтобы соединиться со всем имеющимся магнием и кремнием, но это не так, потому что кислород-легкий элемент, и некоторая его часть после этого еще останется. Вследствие своей электроотрицательности железо ведет себя как халькофильный элемент и автоматически будет соединяться с имеющейся серой. Однако некоторая часть железа должна соединиться с остающимся кислородом и вести себя, таким образом, как литофильный элемент.
Тем не менее большая распространенность железа обусловливает возможность того, что часть его останется в металлическом виде после использования всего кислорода и всей серы; следовательно, в планетах земной группы образуется сидерофильный слой. Это особенно вероятно, если кислород улетучился , и поэтому количество кислорода на планете определяет размер сидерофильного слоя.
В результате образования указанных соединений должны возникнуть три отдельных слоя, в которых будут преобладать последовательно 1) силикаты магния и железа, 2) FeS
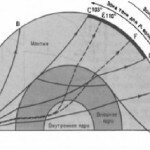
Приблизительное содержание главных химических элементов, образующих 92% массы твердого вещества планеты
Приблизительное содержание главных химических элементов, образующих 92% массы твердого вещества планеты, имеющей такой же состав, как у углистых хондритов. Органические соединения, вода и другие элементы составляют вместе остальные 8% . Заметим, что показанная на рисунке распространенность элементов та же, на основании изучения числа атомов метеоритов, но здесь она преобразована в относительные атомные массы (путем деления на атомные веса). Это повышает кажущееся обилие железа, но в иных отношениях не влияет на порядок распространенности элементов, установленный металлическое железо. При условии, что температура достаточно высока, эти слои расположатся в порядке плотности. Таким образом, предполагается, что в ядре Земли должны существовать внутренняя металлическая область и внешняя область, богатая сульфидами; кора и мантия должны иметь силикатный состав.
Это сидерофильный, халькофильный и литофильный слои, а остающиеся металлические элементы (М) распределятся по этим слоям в соответствии со своими электрохимическими свойствами. В течение всей истории активного развития планет земной группы происходят равновесные реакции, такие, как М-сульфид + Fe-силикат ^ М-силикат + Fe-сульфид М -I- Fe-сульфид М-сульфид + Fe, постепенно сортируя три указанные категории элементов и направляя их в соответствующие слои. На Земле эффективность этого процесса была высокой благодаря долгому периоду внутренней активности, но разделение элементов в полной мере еще не достигнуто.
Например, в земной коре до сих пор обнаруживаются следы золота и платины, хотя наибольшее содержание этих элементов должно быть в ядре планеты (чем не заманчивый объект разработки для предприимчивого старателя?). Если же говорить серьезно, на любой планете такие элементы, как алюминий, кальций и щелочные, должны накапливаться почти исключительно в мантии и коре, а никель должен входить в состав ядра.
Что деление на слои в решающей степени зависит от того, сколько имеется кислорода и серы
В конце данного раздела имеет смысл повторить, что деление на слои в решающей степени зависит от того, сколько имеется кислорода и серы. Если бы Земля действительно состояла из вещества углистых хондритов, которое сильно окислено, то она была бы почти целиком литофильной с малым халькофильным ядром (около 20% всей массы Земли приходилось бы на FeS) и без каких-либо свободных металлов. Поскольку же Земля имеет весьма значительное ядро (32% ее массы), из этого следует, что, если во всех других отношениях ее химизм близок к химизму углистых хондритов, она должна была потерять несколько процентов кислорода. Таким образом, общее окисленное состояние планеты может определять размер ее ядра, присутствие в нем металлической области и положение границ между соответствующими слоями.
 Планетарное нагревания
Планетарное нагревания Геологическая история земли
Геологическая история земли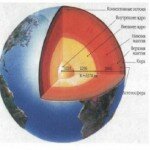 Происхождение планеты земля
Происхождение планеты земля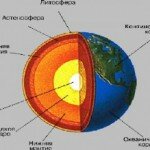 Внутри планеты земля
Внутри планеты земля Температура ядра земли
Температура ядра земли