Необходимые для жизни условия
Хотя жизнь основана на клеточной структуре, генетической информации и ее репликации и эволюции со временем, всего этого еще не достаточно для того, чтобы жизнь могла существовать.

Структуры и функции создают жизнеспособную единицу только в той окружающей среде, которая способна ее поддержать. Для всех своих процессов жизнь нуждается в энергии. Практически единственный исходный источник энергии для жизни на Земле — это Солнце. Его энергию используют даже животные, питающиеся растениями, которым для роста нужен солнечный свет. Впрочем, некоторые бактерии и археи живут за счет энергии, добываемой химическим путем из минералов, но эти источники энергии очень ограничены и не могут поддерживать существование биосферы значительного объема. Жизнь также нуждается в питательных веществах — строительном материале для поддержания и воспроизведения своей структуры. Это органические соединения, а также и минеральные, существующие в окружающей среде и циркулирующие между органическими и неорганическими соединениями. А еще жизни нужен растворитель, чтобы растворять и переносить все эти химикаты. Здесь на Земле растворителем служит вода, которая к тому же является важным компонентом живых организмов.
Без сомнения, вода — самый подходящий растворитель для всех биохимических реакций. Молекула воды состоит из одного атома кислорода и двух атомов водорода, связанных между собой ковалентными связями; это означает, что общая электронная пара движется вокруг атома кислорода и каждого из атомов водорода
Атом кислорода притягивает электроны сильнее, чем водород, поэтому они располагаются ближе к кислороду. Это приводит к тому, что кислородный конец молекулы имеет небольшой отрицательный заряд, а водородный конец — положительный: молекула воды является электрическим диполем (полярной молекулой). Эта особенность сильно влияет на химические свойства воды. Электрическая полярность молекул воды вызывает слабое электростатическое взаимодействие — водородную связь — между соседними молекулами (см. рис. 28.12); это заставляет воду вести себя как объединенную слабосвязанную сеть. Водородные связи вынуждают молекулы притягивать друг друга, превращая жидкость в немного «липкую», вязкую. Изза этой «липкости» нужна довольно высокая температура и много тепловой энергии, чтобы испарить воду, перевести ее в газовую форму. Поэтому вода сохраняет жидкое состояние в широком диапазоне температуры. Эта «липкость» препятствуег также повышению температуры воды (усилению теплового движения молекул), потому для этого требуется много тепловой энергии. С другой стороны, так же много энергии высвобождается при остывании воды; это делает воду очень хорошим термостатом — и в окружающей среде, и внутри клетки.

Рис.. Молекулы воды в жидком состоянии (слева) и в составе льда (справа). Водородные связи показаны линиями
Вода охотно взаимодействует с другими заряженными молекулами; это делает ее очень хорошим растворителем всех ионных соединений из положительно или отрицательно заряженных атомов. Вода растворяет и полярные соединения, когда положительный и отрицательный заряды находятся в одной молекуле, но раздельно (как у воды). С другой стороны, вода не может растворять неполярные молекулы, такие как длинные незаряженные углеводородные цепочки.
Это свойство очень важно для биологии, поскольку оно означает, что эти молекулы «гидрофобны», то есть в водном растворе они стремятся объединиться друг с другом, а не с молекулами воды.
Очень важным типом молекул являются липиды (жиры). К одному концу такой молекулы прикреплена полярная или заряженная группа, делающая этот конец гидрофильным, то есть растворяющимся в воде. А к другому концу прикреплена неполярная группа (например, углеводородная цепочка), превращающая этот конец в гидрофобный. Такие молекулы с двойными свойствами амфифильны: они собираются в водном растворе и образуют двухслойные мембраны. Гидрофильные и гидрофобные взаимодействия сильно влияют на образование трехмерной структуры и всех других молекул, включая белки, и помогают им принять правильную функциональную форму.
Из-за притяжения водородных связей и под действием поверхностного натяжения и испарения вода в окружающей среде ведет себя очень хорошо. Благодаря капиллярному эффекту она может двигаться против притяжения, например в сосудистой системе растений, по которой она поднимается до кроны высоких деревьев. Вода движется и по капиллярным каналам почвы, самостоятельно поднимаясь с уровня грунтовых вод к корневой системе растений. Водородные связи влияют и на плотность воды при разной температуре совершенно особым образом. При понижении температуры водородные связи становятся сильнее и короче, так что при температуре +4 °С молекулы воды располагаются наиболее близко друг к другу; при этой температуре вода наиболее плотная. При дальнейшем снижении температуры молекулярная конфигурация начинает меняться в сторону более слабых шестиугольных водородных связей, типичных для кристаллов льда, поэтому объем воды начинает увеличиваться. Лед низкой плотности образуется на поверхности воды при температуре о °С, а более плотная вода с температурой +4 °С остается на дне водоема. Таким образом, если водоем достаточно глубокий или мороз не слишком сильный, вода с температурой +4 °С может оставаться в жидкой форме под ледяной корой даже в холодный период, что позволяет выжить в глубокой воде и не замерзнуть подо льдом. Это очень важное и очень редкое свойство. Например, аммиак, который, возможно, мог бы быть подходящим альтернативным растворителем для жизни, в твердой форме тяжелее, чем в жидкой.
Это означает, что пруд из аммиака промерзал бы до дна и мог бы все время оставаться замерзшим. Изза отсутствия водородных связей аммиак существует в жидком состоянии только в очень узком диапазоне температур и при гораздо более низких температурах, чем вода (между 78 °С и 33 °С на уровне моря). При этих температурах все биохимические реакции протекали бы очень медленно. Кроме того, аммиак легко разрушается ультрафиолетовым светом, и его легкий компонент — водород легко улетает в космос. Солнечные ультрафиолетовые лучи разрушают и воду, но эта реакция протекает медленнее и дает кислород (Оа) и озон (Оэ), который блокирует ультрафиолетовое излучение и предотвращает дальнейшее разрушение воды. Поэтому вода существует в большом количестве в атмосферах планет, похожих на Землю, а аммиак — нет.
 Основные свойства живого
Основные свойства живого Генетика и эволюция жизни
Генетика и эволюция жизни Генетический код и его экспрессия
Генетический код и его экспрессия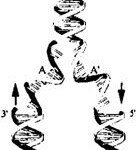 Молекула ДНК
Молекула ДНК Открытие генетики и ее химические основы
Открытие генетики и ее химические основы